Nederlands Onlangs publiceerde JAMA Oncology (IF 33.012) een belangrijk onderzoeksresultaat [1] van het team van Prof. Cai Guo-ring van het Cancer Hospital van de Fudan University en Prof. Wang Jing van het Renji Hospital van de Shanghai Jiao Tong University School of Medicine, in samenwerking met KUNYUAN BIOLOGY: "Vroege detectie van moleculaire restziekte en risicostratificatie voor colorectale kanker in stadium I tot III via circulerende tumor-DNA-methylering en risicostratificatie)". Deze studie is de eerste multicenterstudie ter wereld waarin PCR-gebaseerde bloed-ctDNA-multigene methyleringstechnologie wordt toegepast voor de voorspelling en monitoring van recidieven van colorectale kanker, wat een kosteneffectievere technische route en oplossing biedt in vergelijking met bestaande MRD-detectietechnologiemethoden, waarvan wordt verwacht dat het het klinische gebruik van de voorspelling en monitoring van recidieven van colorectale kanker aanzienlijk zal verbeteren en de overleving en kwaliteit van leven van de patiënt aanzienlijk zal verbeteren. De studie werd ook hoog gewaardeerd door het tijdschrift en zijn redacteuren en werd in dit nummer vermeld als een belangrijk aanbevolen artikel. Professor Juan Ruiz-Bañobre uit Spanje en professor Ajay Goel uit de Verenigde Staten werden uitgenodigd om de studie te beoordelen. De studie werd ook gepubliceerd door GenomeWeb, een toonaangevend biomedisch medium in de Verenigde Staten.

Colorectale kanker (CRC) is een veelvoorkomende kwaadaardige tumor van het maag-darmkanaal in China. Gegevens van het Internationaal Agentschap voor Kankeronderzoek (IARC) uit 2020 tonen aan dat 555.000 nieuwe gevallen in China goed zijn voor ongeveer 1/3 van de wereld, waarbij het incidentiecijfer naar de tweede plaats springt van veelvoorkomende kankers in China; 286.000 sterfgevallen maken ongeveer 1/3 van de wereld uit, wat neerkomt op de vijfde meest voorkomende doodsoorzaak door kanker in China. De vijfde doodsoorzaak in China. Het is opmerkelijk dat onder de gediagnosticeerde patiënten de TNM-stadia I, II, III en IV respectievelijk 18,6%, 42,5%, 30,7% en 8,2% bedragen. Meer dan 80% van de patiënten bevindt zich in het midden- en late stadium en 44% van hen heeft gelijktijdige of heterochrone uitzaaiingen op afstand naar lever en long, die de overlevingsperiode ernstig beïnvloeden, de gezondheid van onze inwoners in gevaar brengen en een zware sociale en economische last veroorzaken. Volgens de statistieken van het Nationaal Kankercentrum bedraagt de gemiddelde jaarlijkse kostenstijging voor de behandeling van colorectale kanker in China ongeveer 6,9% tot 9,2%, en kunnen de persoonlijke gezondheidszorgkosten van patiënten binnen een jaar na de diagnose 60% van het gezinsinkomen opslokken. Kankerpatiënten lijden aan de ziekte en staan ook onder grote economische druk [2].
Negentig procent van de colorectale kankerlaesies kan operatief worden verwijderd. Hoe eerder de tumor wordt ontdekt, hoe hoger de vijfjaarsoverleving na radicale chirurgische resectie. De totale recidiefkans na radicale resectie bedraagt echter nog steeds ongeveer 30%. De vijfjaarsoverleving van colorectale kanker in de Chinese bevolking bedraagt respectievelijk 90,1%, 72,6%, 53,8% en 10,4% voor stadium I, II, III en IV.
Minimale restziekte (MRD) is een belangrijke oorzaak van tumorrecidief na radicale behandeling. De technologie voor MRD-detectie van solide tumoren is de afgelopen jaren snel vooruitgegaan en diverse belangrijke observationele en interventionele studies hebben bevestigd dat de postoperatieve MRD-status een indicatie kan zijn van het risico op postoperatief recidief van colorectale kanker. ctDNA-testen hebben de voordelen dat ze niet-invasief, eenvoudig en snel zijn, een hoge toegankelijkheid van het monster bieden en tumorheterogeniteit tegengaan.
De Amerikaanse NCCN-richtlijnen voor colonkanker en de Chinese CSCO-richtlijnen voor colorectale kanker stellen beide dat ctDNA-testen prognostische en voorspellende informatie kunnen opleveren voor het bepalen van het risico op postoperatieve recidief en de selectie van adjuvante chemotherapie bij colonkanker. Deze informatie kan helpen bij beslissingen over adjuvante behandeling voor patiënten met colonkanker stadium II of III. De meeste bestaande studies richten zich echter op ctDNA-mutaties op basis van high-throughput sequencingtechnologie (NGS), die een complex proces, een lange doorlooptijd en hoge kosten met zich meebrengt [3], met een geringe mate van generaliseerbaarheid en een lage prevalentie onder kankerpatiënten.
Bij patiënten met stadium III colorectale kanker kost NGS-gebaseerde dynamische ctDNA-monitoring tot wel $ 10.000 voor een enkel consult en is een wachttijd van maximaal twee weken vereist. Met de multigenmethyleringstest in deze studie, ColonAiQ®, kunnen patiënten dynamische ctDNA-monitoring ondergaan voor een tiende van de kosten en binnen twee dagen een rapport ontvangen.
Volgens de 560.000 nieuwe gevallen van colorectale kanker die elk jaar in China voorkomen, hebben de klinische patiënten, voornamelijk met colorectale kanker in stadium II-III (het aandeel is ongeveer 70%), een dringendere vraag naar dynamische monitoring, waardoor de markt voor dynamische MRD-monitoring van colorectale kanker elk jaar miljoenen mensen bereikt.
De onderzoeksresultaten zijn van groot wetenschappelijk en praktisch belang. Grootschalige prospectieve klinische studies hebben bevestigd dat PCR-gebaseerde multigenmethyleringstechnologie voor bloed-ctDNA kan worden gebruikt voor de voorspelling en monitoring van recidief bij colorectale kanker, met zowel gevoeligheid, tijdigheid als kosteneffectiviteit, waardoor meer kankerpatiënten profijt kunnen hebben van precisiegeneeskunde. De studie is gebaseerd op ColonAiQ®, een multigenmethyleringstest voor colorectale kanker, ontwikkeld door KUNY. De klinische waarde ervan bij vroege screening en diagnose is bevestigd door een centrale klinische studie.
Gastroenterology (IF33.88), het toonaangevende internationale tijdschrift op het gebied van gastro-intestinale ziekten in 2021, rapporteerde de multicenter onderzoeksresultaten van het Zhongshan Hospital van de Fudan Universiteit, het Cancer Hospital van de Fudan Universiteit en andere gezaghebbende medische instellingen in samenwerking met KUNYAN Biological, die de uitstekende prestaties van ColonAiQ® ChangAiQ® bij vroege screening en vroege diagnose van colorectale kanker bevestigden en in eerste instantie de Het onderzoekt ook de potentiële toepassing bij de prognosebewaking van colorectale kanker.
Om de klinische toepassing van ctDNA-methylering bij risicostratificatie, het sturen van behandelbeslissingen en het vroegtijdig monitoren van recidief bij colorectale kanker in stadium I-III verder te valideren, includeerde het onderzoeksteam 299 patiënten met colorectale kanker in stadium I-III die een radicale operatie ondergingen en bloedmonsters verzamelden op elk follow-uppunt (met drie maanden ertussen) binnen één week vóór de operatie, één maand na de operatie en bij postoperatieve adjuvante therapie voor dynamische ctDNA-bloedtesten.
Ten eerste werd ontdekt dat ctDNA-testen het risico op recidief bij patiënten met colorectale kanker vroegtijdig konden voorspellen, zowel preoperatief als vroeg postoperatief. Preoperatieve ctDNA-positieve patiënten hadden een hogere kans op postoperatief recidief dan preoperatieve ctDNA-negatieve patiënten (22,0% > 4,7%). Vroege postoperatieve ctDNA-testen voorspelden nog steeds het recidiefrisico: één maand na radicale resectie hadden ctDNA-positieve patiënten 17,5 keer meer kans op recidief dan negatieve patiënten; het team ontdekte ook dat gecombineerde ctDNA- en CEA-testen de prestaties bij het detecteren van recidief licht verbeterden (AUC = 0,849), maar het verschil was niet significant vergeleken met ctDNA-testen (AUC = 0,839) alleen. Het verschil was niet significant vergeleken met ctDNA-testen alleen (AUC = 0,839).
Klinische stadiëring gecombineerd met risicofactoren is momenteel de belangrijkste basis voor risicostratificatie van kankerpatiënten, en in het huidige paradigma recidiveren nog steeds veel patiënten [4], en is er een dringende behoefte aan betere stratificatie-instrumenten aangezien overbehandeling en onderbehandeling naast elkaar bestaan in de kliniek. Op basis hiervan classificeerde het team patiënten met stadium III colorectale kanker in verschillende subgroepen op basis van klinische beoordeling van het recidiefrisico (hoog risico (T4/N2) en laag risico (T1-3N1)) en adjuvante behandelperiode (3/6 maanden). De analyse wees uit dat patiënten in de subgroep met hoog risico van ctDNA-positieve patiënten een lager recidiefpercentage hadden als ze zes maanden adjuvante therapie kregen; in de subgroep met laag risico van ctDNA-positieve patiënten was er geen significant verschil tussen de adjuvante behandelcyclus en patiëntuitkomsten; terwijl ctDNA-negatieve patiënten een significant betere prognose hadden dan ctDNA-positieve patiënten en een langere postoperatieve recidiefvrije periode (RFS); stadium I en laagrisico stadium II colorectale kanker Bij alle ctDNA-negatieve patiënten trad binnen twee jaar geen recidief op. Daarom wordt verwacht dat de integratie van ctDNA met klinische kenmerken de risicostratificatie verder zal optimaliseren en recidief beter zal voorspellen.
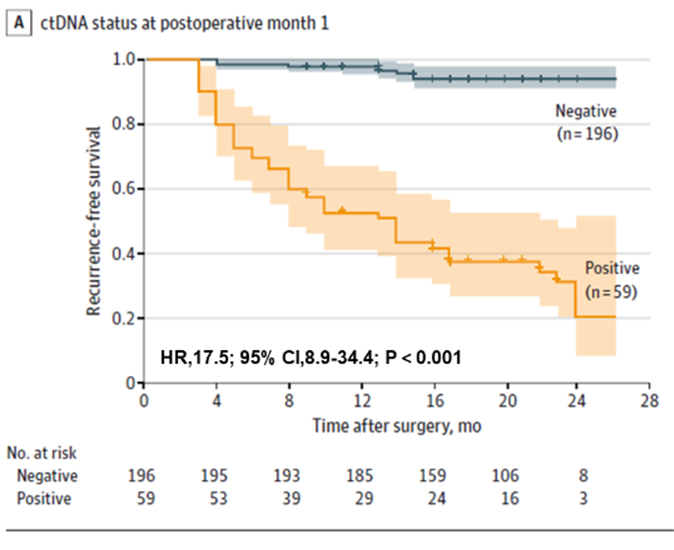
Figuur 1. Plasma-ctDNA-analyse bij POM1 voor vroege detectie van colorectale kankerrecidief
Uit verdere resultaten van dynamische ctDNA-testen bleek dat het risico op recidief significant hoger was bij patiënten met een positieve dynamische ctDNA-test dan bij patiënten met een negatieve ctDNA tijdens de fase van monitoring van terugkeer van de ziekte na definitieve behandeling (na radicale chirurgie + adjuvante therapie) (Figuur 3ACD). Bovendien kan ctDNA tot 20 maanden eerder dan beeldvorming op terugkeer van de tumor wijzen (Figuur 3B). Dit biedt de mogelijkheid tot vroege detectie van terugkeer van de ziekte en tijdige interventie.
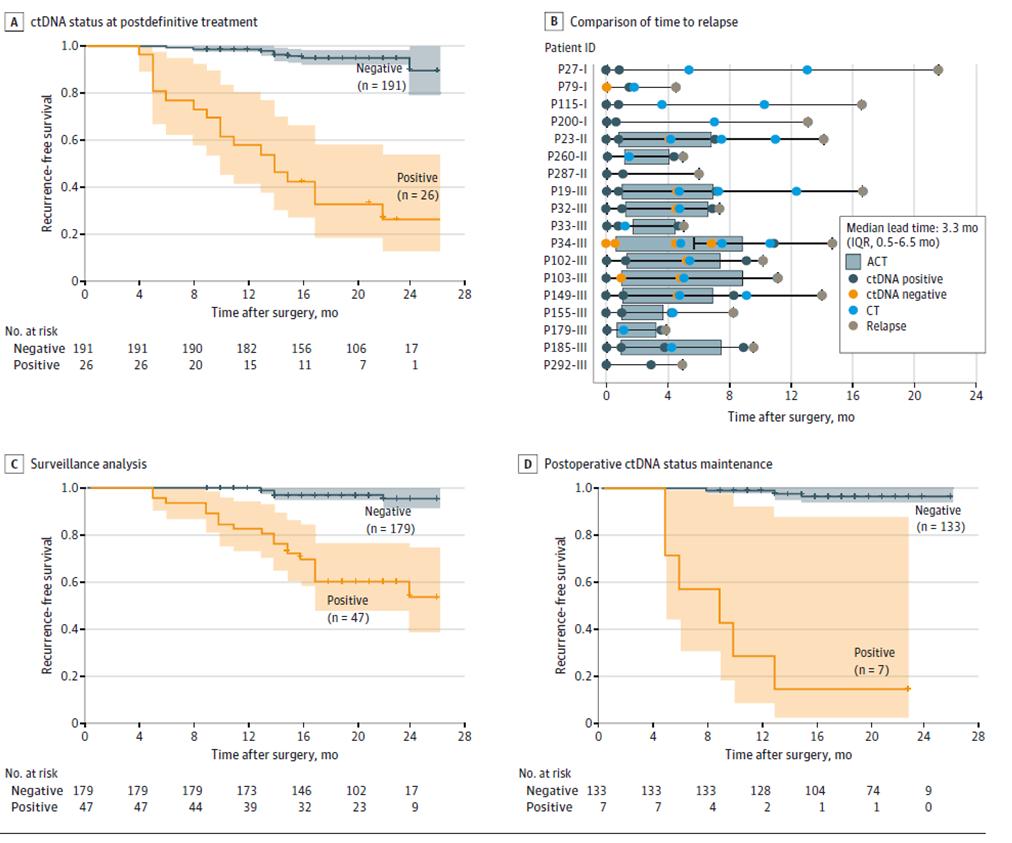
Figuur 2. ctDNA-analyse op basis van een longitudinaal cohort om terugkeer van colorectale kanker te detecteren
“Een groot aantal translationele geneeskundeonderzoeken bij colorectale kanker is toonaangevend in deze discipline. Vooral ctDNA-gebaseerde MRD-testen laten een groot potentieel zien om de postoperatieve behandeling van patiënten met colorectale kanker te verbeteren door stratificatie van het risico op recidief mogelijk te maken, behandelbeslissingen te sturen en vroegtijdig toezicht op recidief te houden.
Het voordeel van het kiezen van DNA-methylering als nieuwe MRD-marker ten opzichte van mutatiedetectie is dat er geen volledige genoomsequentiescreening van tumorweefsel nodig is, dat het direct kan worden gebruikt voor bloedonderzoek en dat er geen vals-positieve resultaten ontstaan door de detectie van somatische mutaties afkomstig van normaal weefsel, goedaardige ziekten en klonale hematopoëse.
Deze studie en andere gerelateerde studies bevestigen dat ctDNA-gebaseerde MRD-testen de belangrijkste onafhankelijke risicofactor zijn voor recidief van colorectale kanker in stadium I-III en kunnen worden gebruikt om behandelbeslissingen te sturen, waaronder 'escalatie' en 'downgraden' van adjuvante therapie. MRD is de belangrijkste onafhankelijke risicofactor voor recidief na een operatie voor colorectale kanker in stadium I-III.
Het vakgebied MRD ontwikkelt zich snel met een aantal innovatieve, zeer gevoelige en specifieke testen gebaseerd op epigenetica (DNA-methylering en fragmentomics) en genomics (ultradiepe gerichte sequencing of sequencing van het hele genoom). We verwachten dat ColonAiQ® grootschalige klinische studies blijft organiseren en een nieuwe indicator voor MRD-testen kan worden die toegankelijkheid, hoge prestaties en betaalbaarheid combineert en breed inzetbaar is in de dagelijkse klinische praktijk.
Referenties
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Vroege detectie van moleculaire restziekte en risicostratificatie voor colorectale kanker stadium I tot III via circulerende tumor-DNA-methylering. JAMA Oncol. 20 april 2023.
[2] “De last van colorectale kanker in de Chinese bevolking: is die de afgelopen jaren veranderd? , Chinese Journal of Epidemiology, Vol. 41, nr. 10, oktober 2020.
[3] Tarazona N, Gimeno-Valiente F, Gambardella V, et al. Gerichte next-generation sequencing van circulerend tumor-DNA voor het opsporen van minimale restziekte bij gelokaliseerde dikkedarmkanker. Ann Oncol. 1 november 2019;30(11):1804-1812.
[4] Taieb J, André T, Auclin E. Verfijning van adjuvante therapie voor niet-gemetastaseerde dikkedarmkanker, nieuwe normen en perspectieven. Cancer Treat Rev. 2019;75:1-11.
Plaatsingstijd: 28-04-2023
 Ik denk dat dit het geval is
Ik denk dat dit het geval is