Tijdens de PCR-reactie worden vaak verstorende factoren aangetroffen.
Vanwege de hoge gevoeligheid van PCR wordt contaminatie gezien als een van de belangrijkste factoren die de PCR-resultaten beïnvloeden en die tot vals-positieve resultaten kan leiden.
Evenzo kritisch zijn de verschillende bronnen die tot vals-negatieve resultaten leiden. Als een of meer essentiële onderdelen van het PCR-mengsel of de amplificatiereactie zelf worden geremd of verstoord, kan de diagnostische test worden belemmerd. Dit kan leiden tot verminderde efficiëntie en zelfs vals-negatieve resultaten.
Naast remming kan er ook verlies van de integriteit van het doelnucleïnezuur optreden als gevolg van de transport- en/of opslagomstandigheden voorafgaand aan de monsterbereiding. Met name hoge temperaturen of onvoldoende opslag kunnen leiden tot beschadiging van cellen en nucleïnezuren. Cel- en weefselfixatie en paraffine-inbedding zijn bekende oorzaken van DNA-fragmentatie en een hardnekkig probleem (zie figuur 1 en 2). In deze gevallen zullen zelfs optimale isolatie en zuivering niet helpen.
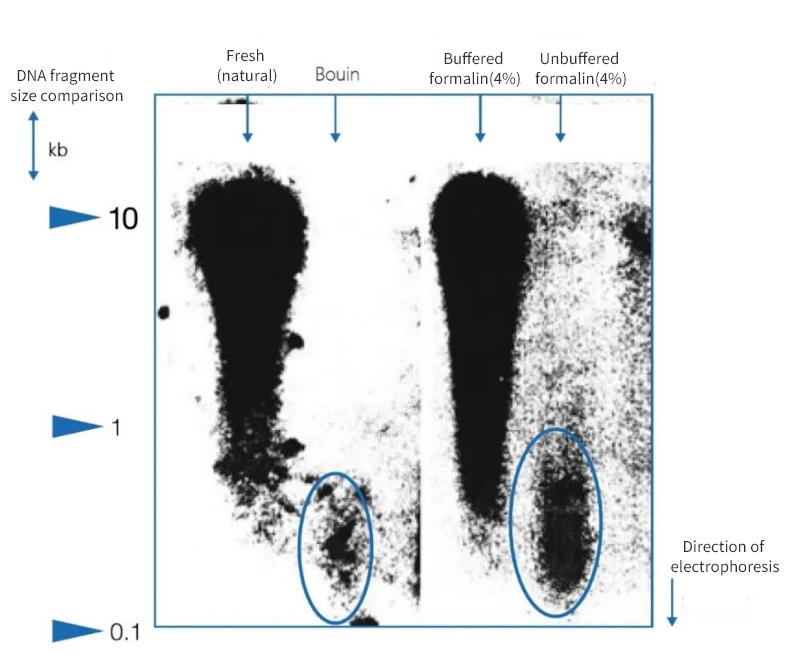
Figuur 1 | Effect van immobilisatie op DNA-integriteit
Agarosegelelektroforese toonde aan dat de kwaliteit van het DNA dat uit autopsieparaffines werd geïsoleerd aanzienlijk varieerde. Afhankelijk van de fixatiemethode werd DNA met verschillende gemiddelde fragmentlengtes in de extracten aangetroffen. DNA werd alleen geconserveerd na fixatie in bevroren monsters en in gebufferde neutrale formaline. Het gebruik van een sterk zuur Bouin-fixeermiddel of ongebufferde, mierenzuurbevattende formaline resulteerde in een aanzienlijk DNA-verlies. De resterende fractie is sterk gefragmenteerd.
Links wordt de lengte van de fragmenten uitgedrukt in kilobaseparen (kbp)
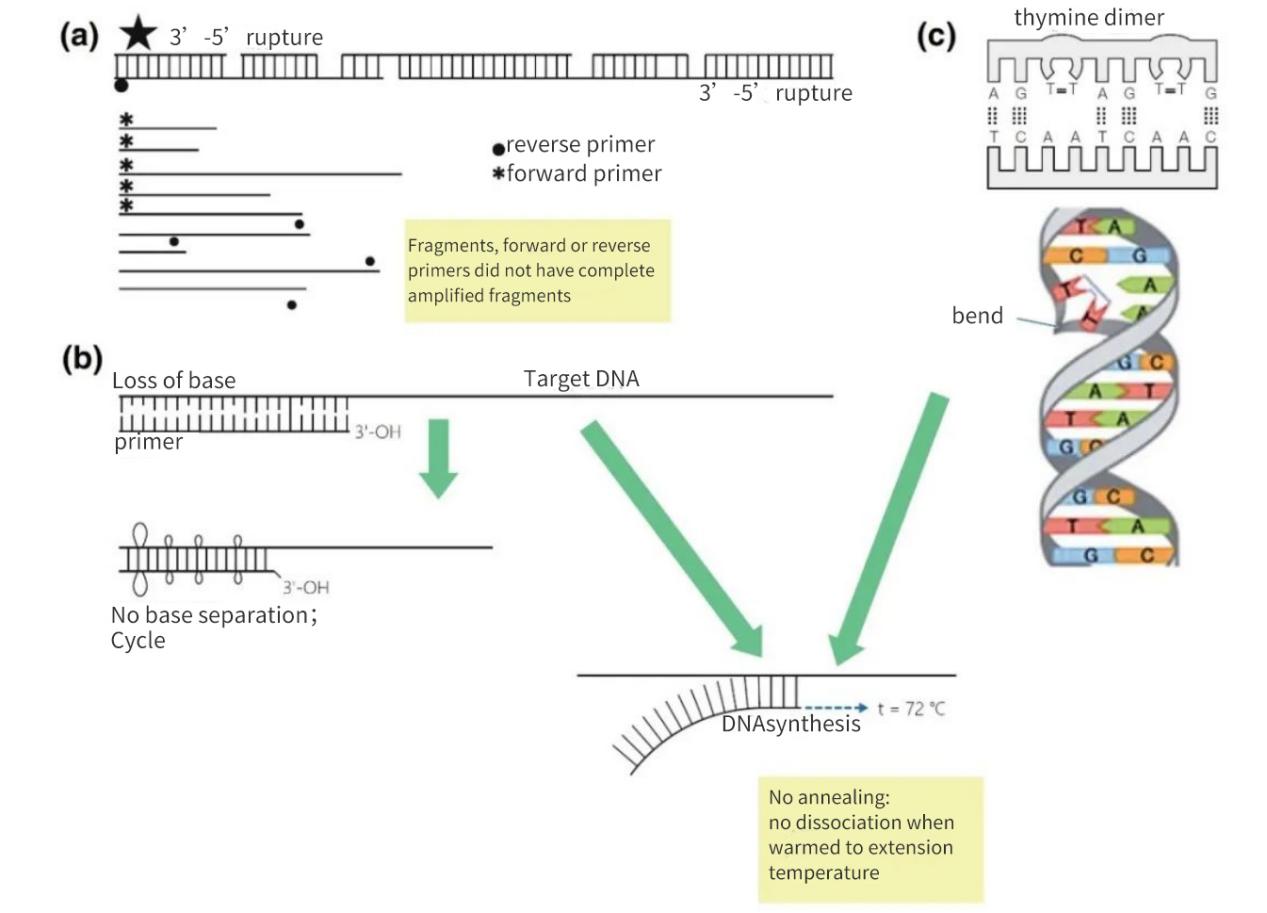
Figuur 2 | Verlies van integriteit van nucleïnezuurdoelen
(a) Een 3'-5'-gat op beide strengen resulteert in een breuk in het doel-DNA. DNA-synthese vindt nog steeds plaats op het kleine fragment. Als er echter een primer-annealingsite op het DNA-fragment ontbreekt, vindt er alleen lineaire amplificatie plaats. In het meest gunstige geval kunnen de fragmenten elkaar herverzadigen, maar de opbrengsten zullen klein zijn en onder de detectiegrens liggen.
(b) Verlies van basen, voornamelijk door depurinatie en de vorming van thymidinedimeren, leidt tot een afname van het aantal H-bruggen en een afname van Tm. Tijdens de verlengde opwarmfase smelten de primers weg van het matrix-DNA en annealen ze niet, zelfs niet onder minder stringente omstandigheden.
(c) Aangrenzende thyminebasen vormen een TT-dimeer.
Een ander veelvoorkomend probleem dat vaak voorkomt in moleculaire diagnostiek is de minder dan optimale afgifte van doelnucleïnezuren in vergelijking met fenol-chloroformextractie. In extreme gevallen kan dit gepaard gaan met vals-negatieve resultaten. Veel tijd kan worden bespaard door kokende lysis of enzymatische digestie van celresten, maar deze methode resulteert vaak in een lage PCR-gevoeligheid vanwege onvoldoende afgifte van nucleïnezuur.
Remming van polymerase-activiteit tijdens amplificatie
In het algemeen wordt remming gebruikt als een containerbegrip om alle factoren te beschrijven die leiden tot suboptimale PCR-resultaten. Strikt biochemisch gezien beperkt remming zich tot de activiteit van het enzym; het vermindert of voorkomt de omzetting van substraat naar product door interactie met de actieve plaats van het DNA-polymerase of zijn cofactor (bijv. Mg2+ voor Taq DNA-polymerase).
Bestanddelen in het monster of diverse buffers en extracten die reagentia bevatten, kunnen het enzym rechtstreeks remmen of de cofactoren ervan (bijv. EDTA) vangen, waardoor het polymerase wordt geïnactiveerd en er minder PCR-resultaten of vals-negatieve resultaten ontstaan.
Veel interacties tussen reactiecomponenten en doelwitbevattende nucleïnezuren worden echter ook aangeduid als 'PCR-remmers'. Zodra de integriteit van de cel door isolatie wordt verstoord en het nucleïnezuur vrijkomt, kunnen er interacties optreden tussen het monster en de omringende oplossing en vaste fase. Zo kunnen 'scavengers' enkel- of dubbelstrengs DNA binden via niet-covalente interacties en de isolatie en zuivering verstoren door het aantal doelwitten dat uiteindelijk het PCR-reactievat bereikt, te verminderen.
Over het algemeen zijn PCR-remmers aanwezig in de meeste lichaamsvloeistoffen en reagentia die worden gebruikt voor klinische diagnostische testen (ureum in urine, hemoglobine en heparine in bloed), voedingssupplementen (organische componenten, glycogeen, vet, Ca2+-ionen) en componenten in het milieu (fenolen, zware metalen).
| Remmers | Bron |
| Calciumionen | Melk, botweefsel |
| Collageen | Weefsel |
| Galzouten | Uitwerpselen |
| Hemoglobine | In het bloed |
| Hemoglobine | Bloedmonsters |
| Humuszuur | Bodem, plant |
| Bloed | Bloed |
| Lactoferrine | Bloed |
| (Europese) melanine | Huid, haar |
| Myoglobine | Spierweefsel |
| Polysacchariden | Plant, ontlasting |
| Protease | Melk |
| Ureum | Urine |
| Mucopolysaccharide | Kraakbeen, slijmvliezen |
| Lignine, cellulose | Planten |
PCR-remmers komen vaker voor in bacteriën en eukaryotische cellen, niet-doelwit-DNA, DNA-bindende macromoleculen van weefselmatrices en laboratoriumapparatuur zoals handschoenen en kunststoffen. Zuivering van nucleïnezuren tijdens of na extractie is de voorkeursmethode voor het verwijderen van PCR-remmers.
Tegenwoordig kunnen diverse geautomatiseerde extractieapparatuur veel handmatige protocollen vervangen, maar 100% recovery en/of zuivering van targets is nog nooit bereikt. Potentiële remmers kunnen nog steeds aanwezig zijn in de gezuiverde nucleïnezuren of al effect hebben gehad. Er bestaan verschillende strategieën om de impact van remmers te verminderen. De keuze van het juiste polymerase kan een aanzienlijke impact hebben op de remmeractiviteit. Andere bewezen methoden om PCR-remming te verminderen, zijn het verhogen van de polymeraseconcentratie of het toevoegen van additieven zoals BSA.
De remming van PCR-reacties kan worden aangetoond door gebruik te maken van interne proceskwaliteitscontrole (IPC).
Zorg ervoor dat alle reagentia en andere oplossingen in de extractiekit, zoals ethanol, EDTA, CETAB, LiCl, GuSCN, SDS, isopropanol en fenol, uit het nucleïnezuurisolaat worden verwijderd door grondig te wassen. Afhankelijk van hun concentratie kunnen ze PCR activeren of remmen.
Geplaatst op: 19 mei 2023
 Ik denk dat dit het geval is
Ik denk dat dit het geval is